在全球新冠病毒感染人数累计超过400万人的今天,疫苗作为抵御病毒全球大流行的终极武器,被人们寄予厚望。那么,全球新冠疫苗知多少?研发进展如何?安全性有保障吗?何时能投入使用?针对这些问题,经济日报记者为您一探究竟。
全球新冠疫苗知多少?
热度:一百多个疫苗在研
近期,世界卫生组织(WHO)总干事谭德塞宣布与全球合作伙伴共同发起“全球合作加速开发、生产、公平获取新冠肺炎防控新工具”的倡议。在欧盟主办的应对新冠肺炎疫情国际认捐大会上,这一倡议得到广泛支持,各国承诺提供74亿欧元资金,用于推动新冠疫苗研发、生产以及公平分配等。
5月8日,国家卫生健康委新闻发言人米锋表示,中方坚定支持并决定参加这一倡议,愿意同国际社会一道为维护全球卫生安全和抗击疫情作出努力。
74亿欧元的承诺,体现了国际社会对新冠疫苗研发的重视。目前全球有多少新冠疫苗正在研发?
WHO官网在5月5日发布的一份题为《COVID-19候选疫苗草图》的文档中,列出了全球8个进入临床试验阶段的新冠病毒疫苗,和100个临床前研究阶段的新冠病毒候选疫苗。这是一份不完全统计,但也足以看出新冠疫苗研发的热度。

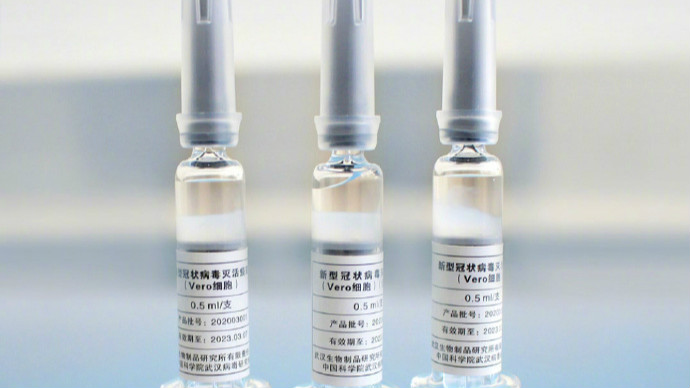
工作人员在国药集团中国生物新冠疫苗生产基地质量检定部门从传递窗拿取新型冠状病毒灭活疫苗样品。 新华社记者 张玉薇摄
进度:8个疫苗进临床试验
那么,新冠疫苗研发的进度如何呢?
目前国际上绝大多数疫苗都处于临床前研究阶段,已经进入临床试验阶段的这8个新冠疫苗显然是进度上的第一梯队。第一梯队中,中国有4个,包括陈薇院士团队研发的腺病毒载体疫苗,和3个灭活疫苗;美国有3个,包括莫德纳公司的mRNA疫苗、辉瑞公司的mRNA疫苗、Inovio公司的DNA载体疫苗;英国有1个,是牛津大学的腺病毒载体疫苗。
这8个疫苗中,进度最快的已进入二期临床研究。其中全球首个启动二期临床研究的新冠疫苗品种,是陈薇院士团队的腺病毒载体疫苗。该疫苗于3月底完成了一期临床试验受试者接种,并于4月12日启动了二期临床试验。4月25日,陈薇院士透露:二期临床试验的508个志愿者已经注射完毕,现在正处于观察期,如果一切顺利将在今年5月揭盲。
全球首个进入二期临床的新冠灭活疫苗也在中国:4月24日,由国药集团中国生物武汉生物制品研究所研发的新型冠状病毒灭活疫苗,正式进入二期临床研究。
全球首个进入二期临床的mRNA疫苗在美国:5月7日,莫德纳公司宣称其mRNA疫苗已获批启动二期临床试验,计划在今夏启动三期临床试验,在明年获得生产销售许可。
最乐观时间点:今年9月
那么,最乐观情况下,疫苗最快在什么时候可以投入紧急使用?目前信息是:今年9月。
在临床试验这一阶段,大多数疫苗研发团队都从小规模试验开始。而牛津大学詹纳研究所的腺病毒载体疫苗,因为此前已经在类似的疫苗接种试验中证明了这种疫苗的安全性,一期临床试验就开启了1100人的规模,5月即将开始第二期和第三期联合试验,涉及5000人,同时验证其有效性和安全性。英国牛津大学疫苗学教授莎拉·吉尔伯特说:“如果得到监管机构的紧急批准,并最终验证疫苗是有效的,那么在9月份第一批数百万剂的疫苗就能生产出来。”
辉瑞和德国制药公司BioNTech宣布,他们的新冠病毒疫苗5月4日起在美国开始人体测试,如果试验成功,该疫苗最早将能于9月做好在美国紧急使用的准备。
“疫苗是解决新冠肺炎最根本办法,不管哪个国家做出来疫苗,都不能供应全世界。这需要互相学习,且做出来后取长补短,可能要由很多厂家来生产,才能够供应全世界。”中国工程院院士、国家卫生健康委高级别专家组组长钟南山在回答媒体记者提问时表示,“中国的疫苗发展非常快,不会比美国差多少。美国据说9月就可以用在人身上,中国也在赛跑,估计前后不会差多少”。

我国工作人员在展示首批获得临床研究批件的新冠病毒灭活疫苗。新华社记者 张玉薇摄
疫苗研发,进军5条路线!
新冠病毒是一种新病毒,疫苗研发有很多不确定因素。虽然最乐观的估计是今年9月就有疫苗能获得应急使用,但失败的可能性也不小,所以鸡蛋不能放在一个篮子里,多种技术路线并进才是多保险方案。那么,新冠疫苗研发有哪些技术路线?它们各自的优缺点是什么?
科技部社会发展科技司司长吴远彬介绍,疫情发生之初,科研攻关组就将疫苗的研发作为主攻方向之一,为了更大限度地提升疫苗研发的成功率,在梳理分析不同的技术基础和可能性之后,科研攻关组布局了病毒的灭活疫苗、核酸疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗这样5条技术路线。
目前,5条路线中,除已进入临床试验阶段的腺病毒载体疫苗和灭活疫苗外,其他3条技术路线的疫苗也在加快推进,预计5月份就会陆续申报临床试验。这5类疫苗各有什么特点?
1、灭活疫苗
灭活疫苗是最传统的经典技术路线:即在体外培养新冠病毒,然后将其灭活,使之没有毒性,但这些病毒的“尸体”仍能刺激人体产生抗体,使免疫细胞记住病毒的模样。目前我国有3个灭活新冠疫苗进入临床研究,其中武汉生物制品研究所研发的新冠病毒灭活疫苗已进入二期临床研究。
灭活疫苗的优点是制备方法简单快速,安全性比较高,它是应对急性疾病传播通常采用的手段。灭活疫苗很常见,我国常用的乙肝疫苗、脊灰灭活疫苗、乙脑灭活疫苗、百白破疫苗等都是灭活疫苗。
但灭活疫苗也有缺点,如接种剂量大、免疫期短、免疫途径单一等,而它最可怕的缺点是有时候会造成抗体依赖增强效应(ADE),使病毒感染加重,这是一种会导致疫苗研发失败的严重不良反应。
2、腺病毒载体疫苗
腺病毒载体疫苗是用经过改造后无害的腺病毒作为载体,装入新冠病毒的S蛋白基因,制成腺病毒载体疫苗,刺激人体产生抗体。S蛋白是新冠病毒入侵人体细胞的关键“钥匙”,无害的腺病毒戴上S蛋白的“帽子”,假装自己很“凶”,让人体产生免疫记忆。陈薇院士团队正在做二期临床试验的新冠疫苗就是腺病毒载体疫苗,这是一种较为成熟的疫苗技术路线。
腺病毒载体疫苗的优点是:安全、高效、引发的不良反应少。这种疫苗有成功先例:此前,由陈薇院士团队和天津康希诺生物技术有限公司联合自主研制的重组埃博拉病毒病疫苗也是用腺病毒作载体。
这种疫苗也有缺点,重组病毒载体疫苗研发需要考虑如何克服“预存免疫”。以进入临床试验的重组新冠疫苗为例,该疫苗以5型腺病毒作载体,但绝大多数人成长过程中曾感染过5型腺病毒,体内可能存在能中和腺病毒载体的抗体,从而可能攻击载体、降低疫苗效果。也就是说,疫苗的安全性高,但有效性可能不足。
3、核酸疫苗
核酸疫苗包括mRNA疫苗和DNA疫苗,是将编码S蛋白的基因,mRNA或者DNA直接注入人体,利用人体细胞在人体内合成S蛋白,刺激人体产生抗体。通俗的说,相当于把一份记录详细的病毒档案交给人体的免疫系统。美国莫德纳公司已获批二期临床试验的mRNA新冠疫苗就属于核酸疫苗。
核酸疫苗的优点是:研制时不需要合成蛋白质或病毒,流程简单,安全性相对比较高。核酸疫苗是全世界都在积极探索的疫苗研发新技术,目前全球还没有核酸疫苗上市。中国一些高校正开展这条路线的研究。
这种疫苗的技术太新了,还没有成功先例,所以也不知道研发过程中前方哪里可能有坑!从产业角度看,虽然其生产工艺本身并不复杂,但全球多数国家该领域基础比较薄弱,尚未形成稳定可控的大规模生产供应链。所以它的缺点是:无成功先例,多数国家无法大规模生产,可能因价格较贵而难以普及到低收入国家。
4、重组蛋白疫苗
重组蛋白疫苗,也称基因工程重组亚单位疫苗。它是通过基因工程方法,大量生产新冠病毒最有可能作为抗原的S蛋白,把它注射到人体,刺激人体产生抗体。相当于不生产完整病毒,而是单独生产很多新冠病毒的关键部件“钥匙”,将其交给人体的免疫系统认识。我国已掌握了大规模生产高质量和高纯度疫苗蛋白的技术,这是一条可以大规模快速生产疫苗的技术路线。
重组亚单位疫苗的优点是:安全、高效、可规模化生产。这条路线有成功先例,比较成功的基因工程亚单位疫苗是乙型肝炎表面抗原疫苗。
重组亚单位疫苗的缺点是需要找到一个好的表达系统,这很困难。它的抗原性受到所选用表达系统的影响,因此在制备疫苗时就需对表达系统进行谨慎选择。
5、减毒流感病毒载体疫苗
减毒流感病毒载体疫苗是用已批准上市的减毒流感病毒疫苗作为载体,携带新冠病毒的S蛋白,共同刺激人体产生针对两种病毒的抗体。简单地说,这种疫苗就是低毒性流感病毒戴上新冠病毒S蛋白“帽子”后形成的融合病毒,可以一石二鸟,既能防流感又能防新冠。在新冠肺炎与流感流行重叠时,其临床意义非常大。由于减毒流感病毒容易感染鼻腔,所以这种疫苗仅通过滴鼻的方式就可以完成疫苗接种。
减毒流感病毒载体疫苗的优点是:一苗防两病,接种次数少,接种方式简单。
病毒减毒活疫苗是非常重要的一类疫苗,我们平时常见的减毒活疫苗有:乙型脑炎减毒活疫苗、甲型肝炎减毒活疫苗、麻疹减毒活疫苗等。但减毒活疫苗的缺点是:研发过程漫长。
需要注意的是,这条技术路线并不是直接将新冠病毒做减毒处理制成疫苗,因为那需要通过长时间的病毒培养传代减毒和筛选;而是把已经减毒的流感病毒疫苗作为载体,将新冠病毒上致病的S蛋白通过生物工程的方法移到减毒的流感病毒疫苗上,这样就可以节省大量的病毒培养传代减毒和筛选时间。

疫苗研发难在哪?
新冠肺炎疫苗的研发,面临着很多困难和障碍。
难点一:认识新敌人
要打败一个新敌人,首先要认识和了解它。新冠病毒是过去18年里第3种通过跨物种传播而导致人类大规模感染的冠状病毒,之前的两种是SARS和MERS。
对同类病毒的研究经验,能帮我们更好地了解新敌人。但遗憾的是,迄今尚无针对某种冠状病毒的疫苗和药物研发出来,SARS和MERS都没有特效药物和成功上市的疫苗。相对于其他病毒而言,我们对新冠病毒的生物学特征、感染过程、致病性,以及人体对它产生的免疫应答仍然知之甚少。对新冠病毒的深入了解,还需花费我们很多时间。
但SARS和MERS还是让我们对冠状病毒的认识水平提高了。此次疫情暴发后,我国科学家迅速完成了新冠病毒基因测序、毒株分离等工作,为疫苗研发打下坚实基础。
难点二:敌人会变身
新冠病毒是一种高度糖基化的RNA病毒,这意味着它容易变身,导致疫苗失效。
糖基化是一种广泛存在、结构复杂多变的蛋白质翻译后修饰,在细胞和机体内发挥着重要功能。有学者对常见的包膜病毒的糖基化位点做了对比:丙型肝炎病毒有4个至11个糖基化位点,流感病毒有5个至11个糖基化位点,埃博拉病毒有8个至15个糖基化位点,艾滋病毒有多达20个至30个糖基化位点。
这些糖基化位点会让病毒容易产生多种突变。病毒糖基化后就相当于用了“易容术”伪装,人体注射疫苗后产生的抗体不一定能够准确识别出体内病毒,也就起不到预防作用了。艾滋病毒的糖基化位点是流感病毒的3倍至6倍,这也是艾滋疫苗研发迟迟无法成功的主要原因之一。
而最新研究显示,新冠病毒是高度糖基化的球形颗粒,有着庞大的结构,至少有66个糖基化位点!新冠病毒的糖基化位点至少是艾滋病毒的2倍,这也意味着疫苗研发工作异常艰难。
难点三:武器反伤己
新冠疫苗是人类应对病毒的武器,但ADE效应有可能让这个武器反过来加深对人类的伤害。ADE是指,当机体遭遇病原体感染时,原有的中和抗体不仅不能防止病毒侵入人体细胞,某些病毒在特异性抗体协助下复制或感染能力还会显著增强,引发更严重的病理损伤。ADE效应成为登革热疫苗数十年艰辛研发历程中的主要障碍之一。
科学家们曾在SARS疫苗研发的灵长类动物实验中发现了ADE作用:如果猴子接种表达SARS病毒刺突蛋白的“重组痘苗-SARS疫苗”后再被SARS病毒感染,急性肺部损伤反而会加重。鉴于新冠病毒与SARS病毒相近的刺突蛋白结构和感染机制,新冠病毒疫苗也存在发生ADE作用的风险,在疫苗设计中应认真加以关注和研究。
不过,这方面近日有个好消息。5月6日,中国科学家在国际顶级学术期刊《科学》上率先发表了新冠病毒疫苗的动物实验结果:《SARS-CoV-2病毒灭活疫苗的快速开发》。研究者开发了一种纯化的灭活新冠病毒候选疫苗,用于动物实验。其中,高剂量组的4只恒河猴感染后的第7天,咽喉、肛门和肺部都未检测到病毒,也没有观察到ADE现象。
除了上述三大困难外,新冠疫苗研发可能还有很多意想不到的困难需要一一克服,因为谁也无法保证疫苗研发一定能成功。艾滋病毒是RNA病毒,从上世纪80年代开始研发疫苗,至今不成功。
不过,我国新冠疫苗的研发目前进展顺利,这让人们对研发结果还是很有信心。中国工程院院士王军志就曾明确表示:截至目前,我国五大技术方向疫苗总体都进展顺利。我国新冠疫苗研发进展目前总体上处于国际先进行列,不会慢于国外。(经济日报·中国经济网记者 佘惠敏)